(Зображення: журнал Knowable, CC BY-ND)
Ще у 2008 році нейровірусолог Рене Дувіль спостерігала щось дивне в мозку людей, які померли від рухового розладу БАС: вірусні білки.
Але ці люди не заразилися жодним відомим вірусом.
Натомість, давні гени, що походять від вірусів і досі ховаються в хромосомах цих пацієнтів, прокинулися та почали виробляти вірусні білки.
Вам може сподобатися
-

Вчені розкривають, як віруси, приховані в нашій ДНК, контролюють наші гени
-

Вакцини мають привабливий потенціал у боротьбі з деменцією
-
Нова кишенькова модель БАС «дихає та тече, як людська тканина»
Наші геноми всіяні уламками давно втрачених вірусів, нащадків вірусних інфекцій, часто мільйони років тому. Більшість цих колись чужорідних фрагментів ДНК належать до типу, який називається ретротранспозонами; вони складають понад 40 відсотків геному людини.
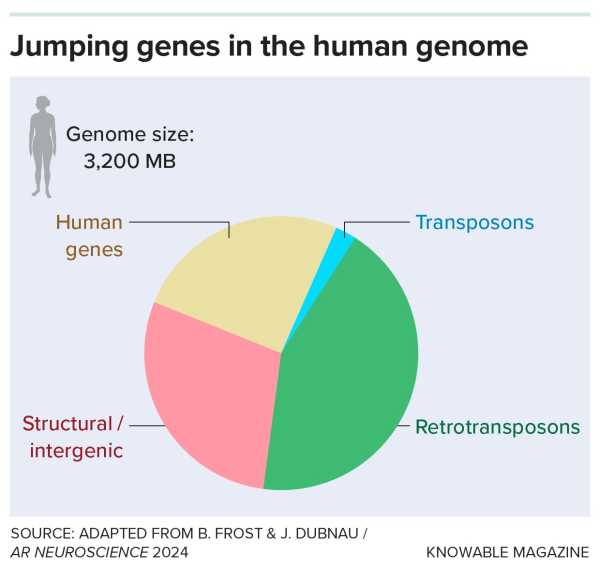
Наші геноми містять ДНК давніх вірусних інфекцій, відомих як гени-стрибки. Більшість із них – це ретротранспозони, які копіюються через проміжні РНК; менша частина – це ДНК-транспозони, що копіюються методом вирізання та вставки.
Наші геноми містять ДНК давніх вірусних інфекцій, відомих як гени-стрибки. Більшість із них – це ретротранспозони, які копіюються через проміжні РНК; менша частина – це ДНК-транспозони, що копіюються методом вирізання та вставки.
Багато ретротранспозонів здаються нешкідливими, здебільшого. Але Дувіль та інші досліджують можливість того, що деякі реактивовані ретротранспозони можуть завдати серйозної шкоди: вони можуть руйнувати нервові клітини та викликати запалення, а також можуть лежати в основі деяких випадків хвороби Альцгеймера та БАС (аміотрофічного бічного склерозу або хвороби Лу Геріга).
Теорія, яка пов'язує ретротранспозони з нейродегенеративними захворюваннями — станами, при яких нервові клітини руйнуються або гинуть, — все ще розвивається; навіть її прихильники, хоча й оптимістичні, налаштовані обережно. «Це ще не єдина думка», — каже Джош Дубнау, нейробіолог Медичної школи «Відродження» при Університеті Стоні-Брук у Нью-Йорку. І ретротранспозони не можуть пояснити всі випадки нейродегенерації.
Однак накопичуються докази того, що вони можуть лежати в основі деяких випадків. Тепер, після більш ніж десятиліття вивчення цієї можливості в тканинах мозку людини, плодових мушок та мишей, дослідники піддають свої ідеї остаточній перевірці: клінічні випробування на людях з БАС, хворобою Альцгеймера та пов'язаними з ними захворюваннями. Ці випробування, в яких антиретровірусні препарати запозичені з фармакопеї ВІЛ, дали попередні, але багатообіцяючі результати.
Тим часом вчені все ще досліджують, як вірусне повторне пробудження переростає в повноцінне захворювання, процес, який може бути позначений тим, що Дубнау та інші називають «штормом ретротранспозонів».
Гени, що стрибають
Ретротранспозон — це свого роду «стрибаючий ген». Ці фрагменти ДНК можуть (або колись могли) переміщатися в геномі, копіюючи або видаляючи себе з одного місця, а потім вставляючи себе в нове. Ретротранспозони — це копіювальні та вставні гени.
Багато ретротранспозонів є давніми супутниками: деякі з них передували еволюції Homo sapiens або навіть розділенню рослин і тварин, каже Дубнау. Його припускає, що їхні попередники, можливо, чергували існування, будучи «вплетеними» в хромосому хазяїна, та існували поза нею.
Деякі ретротранспозони після всього цього часу зберігають свою здатність перестрибувати між ДНК людини. Для цього вони копіюють себе за допомогою ферменту зворотної транскриптази, який також використовується деякими вірусами, такими як ВІЛ, для копіювання послідовностей РНК у ДНК. Після копіювання залишкові віруси можуть розташовуватися в нових місцях на хромосомах.
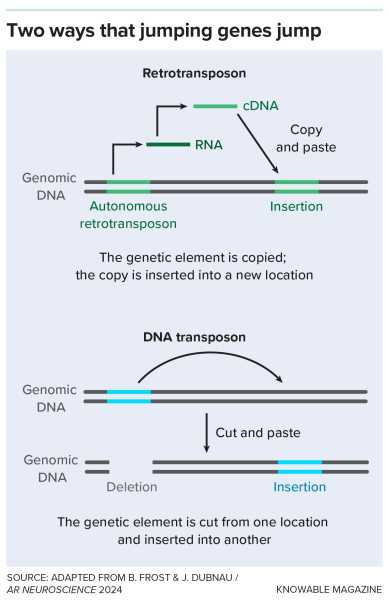
Стрибкові гени використовують різні механізми для переміщення в геномі.
Якщо вам страшно уявити геном, засмічений ретровірусними генами, деякі з яких здатні «стрибати» по геному, не хвилюйтеся, каже Дувіль, який зараз працює в Університеті Манітоби у Вінніпезі. Примітно, що деякі ретротранспозони взяли на себе корисні функції, допомагаючи організму в таких завданнях, як підтримка стовбурових клітин і розвиток ембріона та нервової системи.
А багато ретротранспозонів перебувають у стані спокою або пошкоджені, і клітина має засоби, щоб (здебільшого) тримати їх у тиші. Один із методів полягає в тому, щоб помістити їх у ділянки ДНК, які настільки щільно згорнуті, що молекулярні машини, необхідні для копіювання генів, не можуть до них підійти.
По суті, камера заштовхує їх у шафу та грюкає дверима.
Але з'являється все більше доказів того, що з віком люди можуть скрипіти, пропускаючи ретротранспозони назовні. Що саме вони тоді роблять, невідомо. Деякі вчені вважають, що справа не стільки в тому, що вони стрибають і мутують ДНК, скільки в тому, що їхні вірусоподібні РНК та білки можуть порушувати нормальну клітинну діяльність.
«Я думаю, що насправді токсичність, коли активуються транспозони, полягає в тому, що вони виробляють усі ці фактори, які виглядають для клітини як вірус», — каже Бесс Фрост, нейробіолог з Університету Брауна в Провіденсі, штат Род-Айленд. Клітина реагує, цілком обґрунтовано, захисним запаленням, яке зазвичай пов’язане з нейродегенерацією.
Ретротранспозони також, здається, об'єднуються з білками-убивцями, класично пов'язаними з нейродегенерацією, пошкоджуючи або вбиваючи нервові клітини, і, можливо, навіть провокуючи захворювання.
Встановлення зв'язку ALS
Вчені давно підозрювали зв'язок між вірусами та БАС, який спричиняє дегенерацію рухових нейронів, що контролюють рух. Але зв'язок, коли його нарешті було виявлено, виявився не зовсім таким, як передбачалося.
На початку 2000-х років вчені повідомили, що у деяких людей з БАС у крові та, рідше, у спинномозковій рідині був виявлений вірусний фермент зворотна транскриптаза. У деяких людей рівень зворотної транскриптази був таким же високим, як у людини з ВІЛ-інфекцією.
Але на той час, каже Дубнау, «ніхто не міг знайти вірус».
Зрештою, Дувіль та його колеги виявили докази існування одного з цих вірусів, що залишилися, різновиду ретротранспозону під назвою HERV-K, у мозку деяких людей, які померли від БАС. Звідти вчені почали будувати довод, що пов'язує гени стрибків з БАС у людей, лабораторних тварин та клітин у чашках. У 2017 році команда дослідників повідомила, що в мозку деяких людей з БАС було активовано численні гени стрибків.
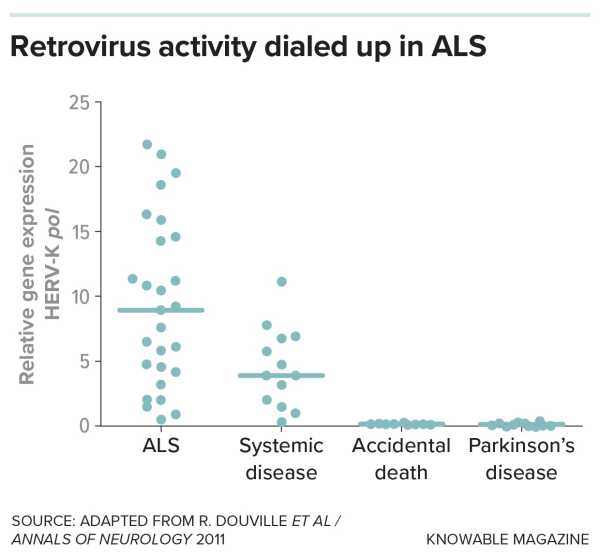
В одному з перших досліджень, що пов'язують ретровіруси та нейродегенерацію, вчені шукали докази того, що гени ретровірусу, відомого як HERV-K, були активовані в тканині мозку людей, які померли від БАС, порівняно з тими, хто помер від інших причин. Активність гена HERV-K під назвою pol, який бере участь у копіюванні ретровірусного геному, була підвищена в багатьох зразках з БАС.
Колеги Дувіля також задокументували шкоду, завдану HERV-K: коли вони ввели ген з ретротранспозону в мишей, проекції нервових клітин тварин зморщувалися, і вони проявляли симптоми, подібні до БАС.
Коли вчені зосередилися на тому, що може пробуджувати HERV-K, з'явився знайомий білок. Його назвали TDP-43, і його вже пов'язували з БАС. Але ще до цього було виявлено, що він бере участь у реакціях клітин на ретровірус ВІЛ.
У 1990-х роках вчені виявили, що TDP-43 діє в ядрі клітини, де він перешкоджає активації генів ВІЛ. Він також регулює там людські гени. Але в нейронах людей з БАС або пов'язаним із ним захворюванням, лобно-скроневою деменцією (ЛСД), TDP-43 залишає ядро та утворює аномальні скупчення в цитоплазмі. Ці скупчення пов'язують з низкою нейродегенеративних захворювань і можуть поширюватися від клітини до клітини. А коли TDP-43 залишає ядро, він також створює прогалину в регуляції генів, порушуючи рівень активності багатьох генів.
Пошкодження TDP-43 достатньо для спричинення нейродегенерації, але дослідження показують, що його втрата ядерної ролі також може пробудити ретротранспозони. Дослідження клітин мозку людей, які померли від БАС або ЛСД, показало, що коли TDP-43 залишає ядро, щільно скручена ДНК поруч із певними ретротранспозонами починає розпушуватися та розплутуватися. І дослідники побачили, що в культивованих клітинах ця втрата TDP-43 звільняла певні ретротранспозони від їхніх обмежень. Двері шафи тепер були прочинені, іншими словами, дозволяючи ретротранспозонам вистрибувати назовні та рухатися.
Тим часом Дубнау та його колеги вивчали дані про TDP-43 та гени, які він контролює, у щурів, мишей та людей. Вони виявили, що TDP-43 може природним чином прилипати до РНК різних генів, що відповідають за стрибки, що свідчить про те, що нормальний TPD-43 може продовжувати їх утримувати, навіть якщо їм вдалося скопіюватись у РНК. Ця взаємодія була змінена у людей з літньою дегенерацією легень (ЛСД) та у гризунів з аномально високою або низькою кількістю TDP-43 — ніби TDP-43 більше не міг контролювати гени, що відповідають за стрибки.
Група Дубнау також звернулася до плодових мушок. Як старість, так і людський ген TDP-43 призвели до того, що ретротранспозони в мозку мухи вислизнули з хромосомної комірчини, спонукаючи клітини мозку вбивати своїх сусідів і провокувати нейродегенерацію, про що група повідомила в серії статей з 2013 по 2023 рік. Більше того, активація певних ретротранспозонів також призвела до злипання TDP-43 поза ядром, створюючи замкнене коло, в якому TDP-43 та ретротранспозони підсилюють аномальну поведінку один одного. Після певної точки, каже Дубнау, «це просто злітає».
Ґрунтуючись на сукупності всіх цих висновків, Дубнау пропонує можливий шлях розвитку БАС: зазвичай TDP-43 у ядрі допомагає пригнічувати ретротранспозони. Але якщо старіння або якесь інше порушення призводить до розпаду TDP-43, ці колись пригнічені ретротранспозони оживають, виробляючи вірусоподібні РНК та білки. Хоча ретротранспозони можуть самостійно викликати захворювання, перестрибуючи в нові ділянки ДНК або стимулюючи запалення, вони також впливають на TDP-43. Вони змушують більше TDP-43 залишати ядро та скупчуватися в цитоплазмі, спричиняючи подальшу нейродегенерацію, яка поширюється на сусідні клітини.
Це не є причиною всіх видів БАС, який є складним розладом з багатьма можливими тригерами. Але в дослідженні посмертних зразків мозку 2019 року Дубнау та його колеги виявили, що приблизно кожна п'ята людина з БАС мала високий рівень активації ретротранспозонів та дисфункцію TDP-43.
Зв'язок між тау-білком та хворобою Альцгеймера
У міру розвитку історії про БАС інші вчені шукали зв'язок між ретротранспозонами та іншим токсичним білком, що сприяє нейродегенерації: тау-білком, який скручується в непокірні клубки в клітинах мозку людей з хворобою Альцгеймера. Він впливає на ретротранспозони, оскільки, як і TDP-43, відіграє певну роль у заспокоєнні ретротранспозонів, каже Фрост.
Таке підтримання є наслідком зв'язку тау-белка з внутрішнім скелетом клітини. Цей скелет фізично пов'язаний зі скелетною структурою ядра, яка, у свою чергу, закріплює щільно змотану ДНК, що пригнічує ретротранспозони. Коли тау-белок порушується, він змінює структуру основного скелета клітини, роблячи його більш жорстким. Фрост і його колеги виявили, що цей структурний дефект поширюється аж до ядерного скелета та хромосом, так само як стягування ниток з одного боку сітки може змінити форму іншого боку.
Цей структурний ефект може розблокувати щільно згорнуті ділянки хромосом у плодових мушок, що пошкоджує їхні нейрони, повідомляла Фрост у 2014 році. До 2018 року вона показала, що проблеми з тау-белком вивільняють стрибкові гени у мух.
«Вони справді стрибали», — каже вона, переходячи з початкових хромосомних локацій до інших у клітинах мозку мухи. А гени стрибків сприяли загибелі нервових клітин.
«Вони справді стрибали».
Бесс Фрост
Фрост та його колеги також вивчали ссавців — мишей — і у 2022 році повідомили, що ретротранспозони також активувалися у мишей з дисфункціональним тау-белком.
Тим часом Фрост та інші досліджували клітини мозку людей, які померли від захворювань, пов'язаних з тау-белком, таких як хвороба Альцгеймера, і також виявили активовані ретротранспозони.
Згідно з роботою іншої команди, опублікованою у 2022 році, це пробудження ретротранспозонів, ймовірно, відбувається на ранніх стадіях захворювання. У зразках крові людей, які перебували на шляху до розвитку хвороби Альцгеймера, копіювання генів ретротранспозонів у РНК різко зросло, створюючи «шторм ретротранспозонів» безпосередньо перед тим, як їхні симптоми стали настільки сильними, що їх можна було назвати хворобою Альцгеймера.
Тактика лікування ВІЛ
Цей зростаючий обсяг доказів свідчить про те, що реактивація колись спокійних ретротранспозонів, чи то через дисфункціональний тау-белок, чи то TDP-43, може призвести до хаосу. На думку швидко спадає потенційний варіант лікування: оскільки ці ретротранспозони дуже схожі на віруси, вчені вважають, що противірусні препарати можуть допомогти.
Зручно, що лікарі вже мають ліки, які заважають ретровірусам: мільйони людей приймають антиретровірусні препарати, щоб контролювати ВІЛ або запобігти його поширенню в їхніх клітинах.
Дійсно, протягом кількох років численні дослідження вивчали препарати з набору ліків для лікування ВІЛ, які блокують фермент зворотну транскриптазу. А в клітинах, мухах та мишах ці препарати знизили активність ретротранспозонів та нейродегенерацію.
Ці препарати добре вивчені та загалом безпечні, і вже проходять випробування для лікування нейродегенеративних захворювань. Наприклад, дослідники перевірили безпеку 24-тижневого антиретровірусного курсу у 40 людей з БАС. Як повідомили дослідники у 2019 році, більшість людей не тільки успішно завершили випробування, але й рівень HERV-K у їхній крові знизився, і, схоже, у них спостерігалася затримка прогресування симптомів БАС.
Фрост нещодавно опублікувала результати невеликого дослідження, в якому 12 людей з ранньою хворобою Альцгеймера приймали інгібітор зворотної транскриптази протягом 24 тижнів. Її головною метою було визначити, чи безпечне лікування, і воно було таким, але дослідники також спостерігали зменшення ознак запалення в спинномозковій рідині учасників.
Дубнау та Фрост входять до складу науково-консультативної ради Transposon Therapeutics, яка випробувала власний інгібітор зворотної транскриптази у 42 людей з БАС та/або ЛСД. Компанія стверджує, що препарат був переносимим і показав менше ознак нейродегенерації та запалення, а також затримку неминучого погіршення симптомів. Компанія планує масштабніше випробування; вона також планує випробувати свій препарат у людей з БАС, хворобою Альцгеймера та пов'язаним з нею захворюванням на основі тау-белка, прогресуючим над'ядерним паралічем.
Ні Фрост, ні Дубнау, які нещодавно разом підсумували цю тему для Щорічного огляду нейронауки, не вважають, що антиретровірусні препарати самі по собі є рішенням для хвороби Альцгеймера або БАС, спричинених транспозонами. Як зазначає Дувіль, препарати були розроблені для дії лише на певні цільові ферменти — вони ніяк не впливають на інші гени ретротранспозонів, РНК або білки, що також може спровокувати запалення, що пошкоджує нерви.
Тим часом вчені розглядають питання не лише БАС та хвороби Альцгеймера, оскільки накопичуються докази того, що ретротранспозони можуть сприяти розвитку інших нейродегенеративних та запальних станів, таких як хвороба Паркінсона та розсіяний склероз.
«Це справді набирає обертів», — каже Фрост.
Ця стаття вперше з’явилася в журналі Knowable, некомерційному виданні, що займається забезпеченням доступності наукових знань для всіх. Підпишіться на розсилку журналу Knowable.

Ембер Денс, наукова письменниця
Ембер Денс — письменниця-фрілансерка з наукових статей, що отримала нагороди та мешкає в Південній Каліфорнії. Вона пише статті для журналу Knowable, є програмним директором «Нових горизонтів у наукових брифінгах» на щорічній конференції Sciencewriters Ради з розвитку наукового письма та викладачкою курсу «Наукове письмо I» в UCLA Extension.
Ви повинні підтвердити своє публічне ім'я, перш ніж коментувати
Будь ласка, вийдіть із системи, а потім увійдіть знову. Після цього вам буде запропоновано ввести своє ім'я для відображення.
Вийти Читати далі

Вчені розкривають, як віруси, приховані в нашій ДНК, контролюють наші гени

Вакцини мають привабливий потенціал у боротьбі з деменцією
Нова кишенькова модель БАС «дихає та тече, як людська тканина»
«Ці рішення були абсолютно необдуманими»: Скорочення фінансування мРНК-вакцин зробить Америку більш вразливою до пандемій
Як битва між вірусами та бактеріями може допомогти нам перемогти супербактерії

Вчені стверджують, що люди можуть мати невикористані «суперсили» від генів, пов’язаних зі сплячкою.

Вчені виявили «спіралі» в ДНК, які утворюються під тиском
Спеціальний захист може допомогти людським яйцеклітинам залишатися свіжими з віком організму

8 «гарячих точок» у геномі, пов’язаних з ME/CFS, у найбільшому дослідженні такого роду

Вчені стверджують, що люди можуть мати невикористані «суперсили» завдяки генам, пов'язаним зі сплячкою

Вчені розкривають, як віруси, приховані в нашій ДНК, контролюють наші гени

Найкраща карта геному людини виявляє «приховані» ділянки ДНК. Останні новини
Залишки стародавніх вірусів складають 40% нашого геному. Вони можуть спровокувати дегенерацію мозку.

2200-річний «складний та витончений» кельтський оберіг воїна свідчить про витончену металообробку залізної доби.

Катастрофічне зіткнення із сусідньою планетою може бути причиною існування життя на Землі сьогодні, натякають нові дослідження
Наукові новини цього тижня: перша у світі трансплантація легень від свині людині, і SpaceX Starship успішно здійснив випробувальний політ

«Я б ніколи не дозволив роботу висиджувати мою дитину»: Опитування щодо «роботів для вагітних» розділило читачів Live Science

Геологія, яка тримає Гімалаї, не така, як ми думали, виявляють вчені ОСТАННІ СТАТТІ

1 Чи є країни, де немає комарів?
Live Science є частиною Future US Inc, міжнародної медіагрупи та провідного цифрового видавництва. Відвідайте наш корпоративний сайт.
- Про нас
- Зв'яжіться з експертами Future
- Умови та положення
- Політика конфіденційності
- Політика щодо файлів cookie
- Заява про доступність
- Рекламуйтеся у нас
- Веб-сповіщення
- Кар'єра
- Редакційні стандарти
- Як запропонувати нам історію
© Future US, Inc. Повний 7-й поверх, 130 West 42nd Street, Нью-Йорк, штат Нью-Йорк, 10036.
var dfp_config = { “site_platform”: “vanilla”, “keywords”: “type-news-daily,type-crosspost,exclude-from-syndication,serversidehawk,videoarticle,van-enable-adviser-”
Sourse: www.livescience.com




